Некоторые химические реактивы для выполнения аналитических работ приходится в лаборатории подвергать очистке. Очистка производится фильтрованием, перегонкой, перекристаллизацией, экстракцией, методами хроматографии и ионофореза.
Фильтрование
Фильтрование проводят для отделения твердых частиц от жидкости, например нерастворимых примесей от раствора реактива. Фильтрование основано на пропускании смеси жидкости с твердой фазой через пористый фильтр, например через фильтровальную бумагу. Поры (отверстия) в бумаге настолько малы, что через них проходит только жидкость, а все твердые частицы остаются на фильтре. Как скорость фильтрования, так и степень очистки зависят от размеров пор фильтра. На скорость фильтрования оказывает большое влияние вязкость жидкости и ее температура. Горячие жидкости всегда фильтруются быстрее, чем холодные.
Для фильтрования применяют стеклянную воронку (см. рис 4), которую укрепляют в кольце штатива или в специальной дощечке с отверстием для фильтрования. Иногда для небольших воронок делают специальный стеклянный крючок, с помощью которого можно прикрепить воронку непосредственно к стакану.
Фильтровальная бумага в отличие от обычной не проклеена, более волокниста, однородна и чиста. Выпускаются также готовые круглые фильтры из обеззоленной бумаги.
Для изготовления фильтра квадратный листок фильтровальной бумаги складывают пополам, затем вчетверо и округляют внешние края ножницами. Отделяют один слой бумаги, образуя угол, и подгоняют фильтр к воронке. Края фильтра должны быть на 3-5 мм ниже края воронки. Пространственный угол воронки должен быть равен 60°, но иногда раструб воронки несколько отклоняется от 60° в большую или меньшую сторону, и тогда фильтр не прилегает плотно к стенкам воронки. В этом случае, несколько меняя угол перегиба фильтра в ту или другую сторону, плотно подгоняют фильтр к стенкам воронки. После подгонки фильтра к воронке его смачивают чистым растворителем, для водных растворов - водой и, поглаживая чистым пальцем, прижимают фильтр к стенкам воронки так, чтобы под ним не было пузырьков воздуха.
Фильтрование проходит довольно быстро, когда в трубке воронки образуется столбик жидкости. Если столбик жидкости в трубке не образовался, тогда в воронку наливают воду выше краев фильтра, затем пальцем немного приподнимают фильтр и опускают его, стекающая жидкость почти всегда образует столбик в трубке воронки. Для этой же цели иногда удлиняют стеклянную трубку воронки резиновой трубкой.
Жидкость для фильтрования сливают в воронку по стеклянной палочке, прислонив к ней носик стакана. Палочку держат над фильтром вертикально, не прислоняя к фильтру. Если в растворе имеется осадок, то нужно дать ему отстояться, профильтровать осторожно большую часть жидкости и только под конец вылить раствор вместе с осадком. Это делается для того, чтобы осадок не забивал пор фильтра в начале фильтрования и чтобы оно не длилось слишком долго.
Для очистки растворов реактивов часто применяют плоеные (складчатые) фильтры, фильтрование через которые происходит гораздо быстрее. Плоеный фильтр делается также из квадратного листа фильтровальной бумаги. Сначала его складывают и обрезают как обычный фильтр (рис. 41). Затем отвертывают половину и правую четвертушку сгибают пополам внутрь, отгибают верхнюю восьмушку и складывают ее пополам, полученную шестнадцатую долю снова складывают пополам. По этой дольке (1/32 фильтра) складывают гармошкой весь фильтр. Готовый фильтр развертывают и вкладывают в воронку. Если фильтр большого размера, то он может прорваться во время фильтрования, для предотвращения этого в воронку вкладывают сначала небольшой обычный фильтр и плотно подгоняют к воронке. Необходимо также при складывании фильтра стремиться к тому, чтобы складки не подходили вплотную к центру фильтра.

Никогда не следует наливать жидкость до самого края фильтра. Конец трубки воронки нужно прислонить к стенке стакана для того, чтобы не было разбрызгивания фильтрата. Если фильтрат получился мутным, его фильтруют еще раз через тот же фильтр.
Концентрированные растворы кислот и щелочей, а также растворы перманганата фильтровать через бумагу нельзя, так как эти вещества разрушают ее. Их фильтруют обычно через стеклянную вату. Для этого вату обрабатывают сначала нагреванием с соляной кислотой, а затем хорошо промывают водой. Такую вату хранят в стакане с дистиллированной водой, а для фильтрования ее вкладывают в угол воронки. После конца фильтрования ее промывают водой и кладут в тот же стакан для хранения. Концентрированные растворы можно также фильтровать через стеклянные фильтрующие воронки с пористой пластинкой, применяя отсасывание.
Для отфильтровывания большой массы твердого вещества от жидкости применяют фильтрование с отсасыванием. Для этого пользуются колбой Бунзена и воронкой Бюхнера (см. рис. 6 и 29). Воронка вставляется в отверстие резиновой пробки, подобранной к горлу колбы Бунзена - толстостенной конической колбы с отростком для отсасывания; на отросток надевается резиновая трубка от водоструйного насоса (рис. 42).

На перегородку воронки кладут два бумажных фильтра соответствующего диаметра, смачивают их дистиллированной водой и плотно прижимают к перегородке стараясь удались все пузырьки воздуха из-под фильтров. Открыв водоструйный насос, проверяют, хорошо ли приложены фильтры. Если фильтры лежат хорошо, то будет слышен спокойный шумящий звук. Если же имеется подсос воздуха, то слышится свистящий звук. В этом случае фильтры прижимают пальцем к сетчатой перегородке до тех пор, пока свист не сменится спокойным шумящим звуком.
Не закрывая водоструйного насоса, сразу же вливают в воронку фильтруемую жидкость (до половины высоты воронки) и периодически добавляют ее, не допуская оголения фильтров. В силу разрежения, создаваемого в колбе Бунзена, жидкость довольно быстро протекает через фильтры. Осадок обычно одновременно с жидкостью переносят на фильтры, хорошо размешав смесь стеклянной палочкой. Рыхлый осадок уплотняют в воронке плоской стеклянной пробкой от бутыли. Отсасывание продолжают до полного прекращения появления капель с носика воронки. Необходимо следить, чтобы колба не наполнялась фильтратом до самого отростка.
Для прекращения отсасывания отсоединяют от колбы Бунзена резиновую трубку, идущую от водоструйного насоса, а затем выключают насос. Если водоструйный насос начать закрывать сразу, не отсоединив от «сосалки», то вода из насоса может попасть в фильтрат вследствие уменьшения давления внутри насоса. Воронку вынимают из колбы, вещество вытряхивают на фильтровальную бумагу и сушат. Фильтрование с отсасыванием применяют при перекристаллизации веществ.
Иногда требуется фильтровать горячие растворы, чтобы они не остывали во время фильтрования. Для этого применяют воронки горячего фильтрования.
Перегонка
Перегонкой (дистилляцией) производят очистку жидких веществ (например, воды, соляной кислоты, спиртов, эфира) от нелетучих примесей. Перегонка основана на том, что жидкость при нагревании до определенной температуры, зависящей от состава жидкости и атмосферного давления, начинает кипеть - бурно переходить в газообразное состояние (пар). Если этот пар охладить, отводя по газоотводной трубке, то он превратится в жидкость. Прибор для перегонки состоит из перегонной колбы 1 (рис. 43), холодильника 2 и приемника 4. Все нелетучие примеси, находящиеся в жидкости в растворенном состоянии, остаются в перегонной колбе.

Для сборки аппарата для перегонки жидкости используют колбу Вюрца - круглодонную колбу с длинной шейкой, от которой отходит длинная узкая отводная трубка. Горло колбы Вюрца закрывают резиновой или корковой пробкой с термометром; пробка должна быть плотно подогнана к горлу колбы. Термометр помещают так, чтобы его резервуар со ртутью был напротив отверстия отводной трубки и не касался стенок горла колбы. Конец отводной трубки пропускают через подогнанную пробку в холодильник Либиха на 3-4 см. Это сочленение также должно быть герметичным. На другом конце холодильника укрепляют аллонж 3 (см. рис. 43) - стеклянную изогнутую трубку, насаживая ее широким концом на пробку, надетую на конец холодильника, который пропущен через пробку на 2-3 см. Суженный конец аллонжа опускается в приемник, которым может быть любая посуда (колба, склянка).
Иногда холодильник Либиха состоит из отдельных частей, не спаянных между собой: холодильной трубки и холодильной рубашки. Для сборки такого холодильника трубку пропускают в рубашку и скрепляют с нею посредством отрезков (колец) резиновой трубки. Резиновую трубку подбирают к муфтам рубашки и надевают на них, затем пропускают через них холодильную (газоотводную) трубку, хорошо смазав ее вазелином и все время поворачивая.
При включении холодильника всегда подсоединяют нижний конец его рубашки, который обращен к приемной колбе, к водопроводному крану резиновой трубкой. От верхнего конца делают отвод в сточную раковину. Нужно следить, чтобы рубашка холодильника всегда была заполнена водой.
Колбу Вюрца укрепляют в лапке штатива так, чтобы ее можно было нагревать. Лапка должна обхватывать горло колбы выше отводной трубки. Подсоединяют колбу к холодильнику, укрепленному на втором штативе. Осторожно вынимают пробку с термометром, вставляют в горло колбы воронку с трубкой, спускающейся ниже отверстия отводной трубки, и наливают в колбу на 2/3 ее объема жидкость, которую нужно перегонять. Помещают в колбу несколько стеклянных капилляров, запаянных с одного конца, чтобы обеспечить равномерное кипение жидкости. Недопустимо во время перегонки бурное вскипание жидкости, так как это может привести к попаданию капель в отводную трубку и к загрязнению дистиллята.
Закрыв колбу пробкой с термометром и проверив надежность сборки прибора, подают воду в холодильник и затем включают нагрев. Обогрев можно вести на газовой горелке через сетку, на водяной бане или другими средствами. После закипания жидкости обогрев уменьшают настолько, чтобы происходило равномерное кипение.
Никогда не следует выпаривать жидкость полностью, ее должно оставаться в перегонной колбе 10-15% от первоначально взятого объема. Для новой заправки колбы обогрев выключают, дают колбе несколько остыть, осторожно вынимают пробку с термометром и доливают жидкость через воронку. Время от времени остатки с загрязнениями следует удалять из перегонной колбы.
Изготовляют также перегонные аппараты целиком из стекла. Такой аппарат состоит из перегонной и приемной колб и холодильника на пришлифованных пробках. Для термометра в пробке перегонной колбы имеется специальный кармашек. Согнутый конец трубки холодильника перед шлифом к приемной колбе имеет отросток для отвода избытка газов.
Многие жидкости имеют свои характерные особенности, которые необходимо учитывать при перегонке. Поэтому прежде чем приступать к перегонке какого-либо вещества, нужно по руководству хорошо ознакомиться с особенностями ее проведения.
В некоторых случаях для перегонки применяют специальный прибор. Он представляет собой цилиндрический сосуд вместимостью 1л, снабженный навинчивающейся крышкой с внутренним конусом (рис. 44). Внутри цилиндра размещены треножник и чашка. Все детали сделаны из фторопласта-4.

Этот прибор используют, например, для получения особо чистой фтористоводородной кислоты для спектрального анализа кремния и его соединений.
В цилиндрический сосуд наливают 500-600 мл очищаемой фтористоводородной кислоты, добавляют 0,2 г спектрально чистого угольного порошка и тщательно перемешивают фторопластовым шпателем. На треножник ставят пустую чашку - приемник. Цилиндрический сосуд закрывают крышкой и помещают на кипящую водяную баню. Крышку сосуда с внешней стороны охлаждают сухим льдом (твердой CO2). Пары кислоты, охлаждаясь на конусообразной стороне крышки, конденсируются и стекают с вершины конуса в чашку. Перегонку ведут со скоростью 15-20 мл/ч. Первую фракцию и кубовой остаток (по 10% от загруженной кислоты) отбрасывают. Для анализа используют среднюю фракцию. Очищенную кислоту хранят во фторопластовом баллончике с хорошо завинчивающейся пробкой.
В описанном приборе кроме фтористоводородной кислоты можно перегонять соляную и азотную кислоты, а также очищать растворы аммиака, этиловый спирт, воду.
Перекристаллизация
Сущность перекристаллизации состоит в том, что очищаемое вещество растворяют в возможно малом объеме горячей воды, раствор отфильтровывают от нерастворимых примесей и фильтрат быстро охлаждают. Вследствие уменьшения растворимости при охлаждении часть вещества выделяется из раствора в виде кристаллов. Растворенные загрязняющие вещества, присутствующие в значительно меньших количествах, чем основное вещество, не выкристаллизовываются, а остаются в маточном растворе. Отделив кристаллы от маточного раствора фильтрованием, получают вещество в довольно чистом состоянии.
Иногда очистить вещество однократной перекристаллизацией не удается, тогда ее повторяют 2-3 раза. Перекристаллизацией нельзя очистить вещество от загрязнений, участвующих в построении кристаллической решетки очищаемого вещества, т.е. образующих с ним так называемые смешанные кристаллы.
Перекристаллизация щавелевой кислоты. Перекристаллизованную щавелевую кислоту состава H2C2O4-2H2O применяют для установки титра растворов перманганата калия KMnO4 или растворов щелочей NaOH или KOH.
Берут в стакан вместимостью 300 мл на лабораторных химических весах 100 г продажной щавелевой кислоты; затем отмеряют мерным цилиндром и наливают в стакан 150 мл горячей дистиллированной воды. Нагревают на газовой горелке (на асбестированной сетке) до полного растворения навески, перемешивая содержимое стакана стеклянной палочкой. На дне может остаться лишь незначительный белый аморфный нерастворимый остаток.
Горячий раствор весь сразу фильтруют через складчатый фильтр, вложенный в воронку с короткой трубкой. В длинной трубке воронки может произойти кристаллизация щавелевой кислоты, и трубка будет забита кристаллами. Во избежание кристаллизации во время фильтрования желательно пользоваться воронкой для горячего фильтрования. Фильтрат собирают в стакан, поставленный в кристаллизатор с холодной водой. После окончания фильтрования фильтрат хорошо перемешивают в течение 10 мин стеклянной палочкой.
Выделившиеся кристаллы отфильтровывают на воронке Бюхнера с отсасыванием. В воронку вкладывают два фильтра, смочив и плотно прижав их ко дну воронки, и включают водоструйный насос. Весь раствор вместе с кристаллами выливают в воронку. Остатки кристаллов очищают стеклянной палочкой со стенок стакана в воронку. Отсасывание ведут до тех пор, пока не прекратится появление капель на кончике трубки воронки, а кристаллы не приобретут снежно-белый цвет. После отсасывания сначала отсоединяют колбу от насоса, а затем закрывают кран водоструйного насоса.
Воронку вынимают из колбы и вытряхивают из нее кристаллы на сложенный вдвое лист фильтровальной бумаги. Стеклянной палочкой распределяют кристаллы ровным слоем, накрывают другим листом сложенным вдвое, и отжимают кристаллы между листами. Если бумага стала мокрой, берут новые листы и снова отжимают кристаллы до тех пор, пока бумага не перестанет увлажняться. Кристаллы «перебирают» стеклянной палочкой, и если они не пристают к ней или полностью отстают от нее при легком встряхивании, то высушивание считают законченным. Кристаллы оставляют на воздухе еще на полчаса, распределив их тонким слоем на листе фильтровальной бумаги, затем пересыпают в банку или бюкс с хорошей пробкой. Выход около 70 г.
Оуэн предложил удобный прибор для перекристаллизации органических веществ для микроанализа (рис. 45). В таком приборе, но только большего размера, можно проводить перекристаллизацию небольших проб веществ для обычного анализа.

Прибор состоит из двух одинаковых кристаллизационных трубок 1 и 5 и центральной части 3. Герметичность соединений создается фланцами 6 и 8, сжатыми пружинным зажимом. Каждую часть изготовляют из стеклянной трубки диаметром 10 мм с припаянными обычными фланцами. Удобно иметь несколько кристаллизационных трубок 1 и 5. Фильтрование проводят через один или два плотных бумажных фильтра 7 диаметром 2 см. Для удаления влаги трубки предварительно хорошо просушивают. Сушку можно проводить продуванием теплого воздуха через отростки 2 или 4, поместив в них кусочки ваты для защиты от попадания атмосферной пыли.
Для отделения нерастворимых примесей в трубке 5 растворяют навеску твердого вещества в соответствующем растворителе, заполняя трубку на 1 см ниже выхода отростка 4. Трубку закрывают пробкой, закрепляют на штативе и подогревают до полного растворения навески. Затем прибор собирают, как показано на рис. 45, вставив между фланцами бумажный фильтр, осторожно переворачивают и фильтруют горячий раствор в трубку-приемник 1. Для ускорения фильтрования можно применять слабое отсасывание через отросток 2 или слабое давление через отросток 4.
Трубку-приемник 1, содержащую чистый фильтрат, используют для кристаллизации вещества путем охлаждения или выпаривания растворителя с отсасыванием. Для кристаллизации центральную часть с трубкой отъединяют и заменяют пробкой (фланец 8). После выделения кристаллов пробку вынимают, на фланцы накладывают бумажный фильтр, прикрепляют центральную часть (трубкой вверх) к другой приемной трубке 5. Затем прибор переворачивают и маточный раствор фильтруют с отсасыванием. Приемник 5 отделяют, фильтрат выливают в сборник, а трубку ополаскивают растворителем. Приемник снова присоединяют к центральной части и прибор переворачивают. Для промывки в трубку с кристаллами через отросток 4 вводят промывную жидкость и содержимое встряхивают. Прибор переворачивают и промывную жидкость отфильтровывают с отсасыванием. Промывку можно повторять много раз.
После промывки основная часть кристаллов оказывается на фильтре. Центральную часть прибора отделяют. Кристаллы вместе с фильтром стряхивают постукиванием на чистый лист фильтровальной бумаги. Кристаллы счищают на фильтр и с фильтром сушат в сушильном шкафу. Гигроскопические вещества высушивают прямо в трубке, при этом центральную часть снимают и заменяют стеклянной крышкой. Отсасывание проводят через трубку 4.
Экстракция
Слово экстракция означает извлечение. Очистка жидкостей экстракцией основана на различной растворимости отдельных веществ в разных растворителях. Очистку экстракцией проводят, взбалтывая раствор с несмешивающейся с водой жидкостью, в которой загрязнения растворяются лучше, чем в воде. Экстракцию проводят в делительной воронке (рис. 46).
Раствор, подвергающийся очистке, наливают не более чем до половины делительной воронки. Туда же добавляют подходящий растворитель, не смешивающийся с водой, в количестве не более половины взятого для очистки раствора. Закрыв делительную воронку и придерживая одной рукой пробку, а другой кран, плавным движением перевертывают воронку несколько раз вверх и вниз. Нельзя энергично взбалтывать содержимое воронки, так как при этом может образоваться устойчивая эмульсия, на расслаивание которой потребуется много времени. Перемешивание нужно вести 15-20 мин так, чтобы слои жидкости как бы скользили один по другому. Время от времени взбалтывание прекращают и в перевернутом состоянии (когда кран приподнят кверху) осторожно приоткрывают кран для выравнивания давления газов.
По окончании экстрагирования делительной воронке дают постоять в штативе до тех пор, пока не произойдет полное расслоение жидкостей и между ними не установится резкая граница. После этого открывают пробку, а затем, осторожно открывая кран, сливают нижний слой жидкости в стакан. Для уменьшения скорости вытекания жидкости под конец истечения кран слегка прикрывают. Затем кран закрывают и выливают оставшуюся жидкость через горло воронки в другой стакан. Для полноты очистки экстракцию повторяют несколько раз.
Очистка дитизона. Для фотометрического определения цинка готовят 0,02%-ный раствор очищенного дитизона в хлороформе. Для этого 0,2 г дитизона растворяют в 20 мл хлороформа и проводят очистку раствора экстракцией. Раствор помещают в делительную воронку вместимостью 600 мл, добавляют 200 мл 2%-ного (по объему) раствора аммиака и хорошо взбалтывают. Дитизон при этом переходит в аммиачный слой. Слой хлороформа отделяют и выбрасывают. Добавляют еще 5 мл хлороформа, снова перемешивают и сливают слой хлороформа. Промывку порциями по 5 мл хлороформа продолжают до тех пор, пока слой хлороформа не перестанет окрашиваться в красный цвет.
В воронку к аммиачному раствору дитизона приливают 50 мл хлороформа, 4 мл соляной кислоты (1:1) и по каплям избыток ее до кислой реакции, затем хорошо перемешивают. Дитизон переходит в хлороформ; раствор окрашивается в зеленый цвет. Слой хлороформа промывают два раза водой. Раствор дитизона сливают в мерную колбу вместимостью 100 мл, доводят хлороформом до метки и хорошо перемешивают.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«Башкирский государственный педагогический
университет им.М. Акмуллы»
(ФГБОУ ВПО БГПУ им.М. Акмуллы)
План-конспект урока на тему:
« Методы очистки веществ»
Выполнил: Маркова Е.
Проверил: к.х.н. Рашидова С.Т.
Методы очистки веществ
Теоретическая часть
Методы очистки и разделения веществ основаны на использовании их различий в химических и физических свойствах. Примерами подобных способов разделения являются перекристаллизация, возгонка и поглощение.
Перекристаллизация - метод очистки, основанный на использовании зависимости растворимости веществ от температуры. Обычно перекристаллизация сводится к растворению вещества в подходящем растворителе при одной температуре и последующем выделении кристаллического осадка при другой температуре, когда раствор становится пересыщенным. Пересыщение одного раствора солей можно достигнуть также путем добавления различных добавок, например, спирта.
Возгонка или сублимация - непосредственное превращение твердого вещества в пар (обычно - при нагревании) минуя жидкое состояние. В дальнейшем пар может быть сконденсирован в кристаллы на охлаждаемой поверхности. Возгонка всегда происходит при температуре ниже температуры плавления вещества. Способностью к возгонке обычно обладают твердые вещества с молекулярной структурой (йод, нафталин, нашатырь, бензойная кислота). Очистка методом возгонки становится возможной в том случае, когда примеси не возгоняются.
Перегонка или дистилляция - метод очистки, основанный на превращении жидкости в пар с последующей конденсацией пара в жидкость. Метод обычно используют для отделения жидкости от растворенных в ней твердых веществ или других нелетучих примесей. Этим методом невозможно разделить компоненты с близкими способностями к парообразованию.
Вода, полученная в результате перегонки, называется дистиллированной.
Метод перекристаллизации основан на различной зависимости растворимости вещества и загрязняющих его примесей от температуры. Перекристаллизацию проводят следующим образом: при повышенной температуре (60 °С) готовят насыщенный раствор очищаемого вещества, полученный раствор фильтруют через воронку для горячего фильтрования для удаления нерастворимых примесей, затем раствор охлаждают. При понижении температуры растворимость вещества понижается и основная часть очищаемого вещества выпадает в осадок. Примеси остаются в растворе, поскольку полученный раствор относительно их остается ненасыщенным. Полученные кристаллы отфильтровывают. Метод позволяет очищать вещества, растворимые в воде, например: хлорид натрия, хлорид аммония, дихромат калия, сульфат меди и др.
Метод сублимации (возгонки) используется для очистки твердых веществ, способных при нагревании переходить из твердой фазы непосредственно в газовую, минуя жидкую фазу. Образующийся газ конденсируется в охлаждаемой части прибора. Возгонку проводят при температуре близкой к температуре плавления вещества. Возможна очистка только от примесей, не способных возгоняться. Метод позволяет очищать вещества, способные возгоняться, например: йод, сера, хлорид аммония и др.
Экспериментальная часть
Опыт 2.1. Очистка йода возгонкой
1. На технохимических весах взвесили 0,3 г кристаллического йода и 0,1 г йодида калия, поместили их в термостойкий стакан для возгонки.
2. Стакан накрыли круглодонной колбой с холодной водой.
3. Стакан осторожно нагревали на электроплите под тягой. Наблюдали возникновение фиолетовых паров и оседание йода на стенках круглодонной колбы.
4. После завершения возгонки нагрев прекратили, кристаллы йода осторожно перенесли на предварительно взвешенную бумагу.
5. Определили массу йода, полученного при возгонке. Она оказалась равной 0,23 г.
6. Определили практический выход йода при очистке по формуле:
Провели очистку йода методом возгонки. Практический выход очищенного йода составил
Опыт 2.2. Очистка воды перегонкой
Рисунок 1. Прибор для перегонки
1. Собрали установку для перегонки воды, схема которой приведена на рисунке 1
Цифрами обозначены:
1 - колба Вюрца с очищаемой водой;
2 - термометр;
3 - холодильник Либиха;
4 - приемник для перегнанной жид-
5 - холодная вода из водопровода;
6 - слив охлаждающей воды
2. Нагревали воду в колбе Вюрца до кипения.
3. Отбросили первые порции дистиллированной воды.
4. Собрали 20 мл дистиллированной воды в коническую колбу.
5. Провели выпаривание на стекле дистиллированной воды и обычной водопроводной воды. Обнаружили, что при выпаривании водопроводной воды остается сухой остаток (белый налет), указывающий на наличие примесей в ней. При выпаривании дистиллированной воды никакого остатка не образуется.
Провели очистку воды методом дистилляции. Обнаружили, что в дистиллированной воде отсутствуют примеси нелетучих веществ.
Опыт 2.3. Очистка углекислого газа
Для получения углекислого газа использовали аппарат Киппа, снаряженный кусками мрамора и 20%-ной соляной кислотой. Образование CO2 происходит по реакции:
CaCO3(тв.) + 2HCl(вод.) CaCl2(вод.) + CO2(газ) + H2O
В качестве примесей к основному продукту могут выступать пары воды и хлороводород.
1. Получаемый в аппарате Киппа газ пропускали через воду в пробирке в течение 2 минут.
2. Проверили наличие хлорид-ионы в полученном растворе с использованием раствора азотнокислого серебра. Наблюдали возникновение помутнения, указывающее на образование AgCl. Данный результат подтверждает присутствие HCl в газообразных продуктах реакции.
3. Получаемый в аппарате газ пропускали через хлоркальциевую трубку, заполненную безводным сульфатом меди (II). Наблюдали возникновение синего окрашивания твердого вещества, указывающего на наличие паров воды в газообразных продуктах реакции.
4. Собрали установку по получению чистого углекислого газа согласно схеме, приведенной на рисунке 2.
5. Экспериментально подтвердили отсутствие примесей HCl и H2O в получаемом углекислом газе.
Опыт 2.4 Очистка твердых веществ.
Задача лабораторной работы: получить m г чистого дихромата калия методом перекристаллизации. Значение m указывается преподавателем каждому учащемуся. Перед выполнением лабораторной работы необходимо выполнить предварительные расчеты.
Предварительные расчеты (пример при m = 10 г):
1. Используя справочную литературу, по таблице растворимости солей при различных температурах определяем растворимость дихромата калия при 20 °С и при 60 °С. Растворимость при 20 °С составляет 11,1 г соли в 100 г раствора, при 60 °С – 31,2 г в 100 г раствора.
2. Вычислим количество соли, которое можно получить при охлаждении до 20 °С 100 г раствора, насыщенного при 60 °С: при 60 °С в насыщенном растворе содержится 31,2 г соли и 68,8 г воды (100 – 31,2), при охлаждении этого раствора до 20 °С количество воды останется неизменным – 68,8 г, а 31,2 г соли распределятся между раствором, насыщенным при 20 °С, и осадком. Определим количество соли, которое останется в растворе. При 20 °С насыщенный раствор массой 100 г содержит 11,1 г соли и 88,9 г воды. Составим пропорцию:
11,1 г соли растворятся в 88,9 г воды,
m г соли растворяется в 68,8 г воды, тогда
![]() (г);
(г);
следовательно, в растворе останется:
m (соли) р-р = m (соли) исх. - m (соли) осадок = 31,2 - 8,6 = 22,6 (г).
Таким образом, при охлаждении до 20 °С 100 г раствора, насыщенного при 60 °С, содержащего 31,2 г соли и 68,8 г воды, образуется 22,6 г осадка (чистой соли).
3. Вычислим количество соли и воды, необходимых для получения 10 г чистой соли. Составим пропорции:
если взять 31,2 г соли, образуется 22,6 г осадка,
если взять m 1 г соли, образуется 10 г осадка, тогда
![]() (г);
(г);
если взять 68,8 г воды, образуется 22,6 г осадка,
если взять m 2 г воды, образуется 10 г осадка, тогда
![]() (г).
(г).
Вычислим объем воды. Плотность воды равна 1 г/мл, следовательно:
![]() (мл).
(мл).
Таким образом, для получения 10 г чистой соли необходимо взять 13,8 г дихромата калия и 30,4 мл воды. К массе соли добавим 10 %, учитывая массу содержащихся примесей:
m (соли) = 13,8 + 0,1 · 13,8 = 15,2 (г).
Порядок выполнения работы
1. Наливаем в стакан отмеренное мерным цилиндром рассчитанное количество воды.
2. Взвешиваем на весах рассчитанное количество соли.
3. Растираем соль в фарфоровой ступке.
4. Помещаем растертую соль в стакан с водой и нагреваем раствор почти до кипения на электрической плитке с асбестовой сеткой, перемешивая стеклянной палочкой.
5. Полученный раствор отфильтровываем через складчатый фильтр, используя воронку для горячего фильтрования для удаления нерастворимых примесей.
6. Охлаждаем полученный раствор до 20 °С.
7. Выпавшие кристаллы отфильтровываем через предварительно взвешенный фильтр.
8. Несколько кристалликов полученной соли растворяем в 2 мл дистиллированной воды и добавляем 1–2 капли раствора нитрата серебра для определения наличия хлоридов.
9. Несколько кристалликов полученной соли растворяем в 2 мл дистиллированной воды и добавляем 1–2 капли раствора хлорида бария для определения наличия сульфатов.
10. Если образуются осадки хлорида серебра и/или сульфата бария, то проводим повторную перекристаллизацию, предварительно рассчитав количество воды, необходимое для приготовления насыщенного при 60 °С раствора, содержащего полученную массу соли.
11. Перекристаллизованный чистый дихромат калия на фильтре помещаем в фарфоровую чашку и высушиваем в сушильном шкафу при 60 °С до постоянной массы (взвешивание проводим каждые 15–20 минут, если после 2 взвешиваний масса не изменилась, то соль высушена).
12. Определяем массу полученной соли, отняв из массы соли с фильтром массу фильтра.
13. Рассчитываем практический выход:

Выход должен составлять не менее 80 %.
Курсовая работа
Способы очистки химических веществ
по дисциплине: Неорганическая химия
Тверь, 2013
Введение
Разделение и очистка веществ являются операциями, обычно связанными между собой. Разделение смеси на составляющие чаще всего преследует цель получения чистых, по возможности без примесей, веществ. Однако само понятие о том, какое вещество следует считать чистым, еще окончательно не установлено, так как требования к чистоте вещества меняются. В настоящее время методы получения химически чистых веществ приобрели особое значение.
Разделение и очистка веществ от примесей основываются на использовании их определенных физических, физико-химических или химических свойств.
Техника важнейших методов разделения и очистки веществ (перегонка и сублимация, экстракция, кристаллизация и перекристаллизация, высаливание) описана в соответствующих главах. Это - наиболее распространенные приемы, чаще всего используемые не только в лабораторной практике, но и в технике.
В отдельных наиболее сложных случаях используют специальные методы очистки.
1. Очистка веществ
.1 Перекристаллизация
Очистка перекристаллизацией основана на изменении растворимости вещества с изменением температуры.
Под растворимостью понимают содержание (концентрацию) растворенного вещества в насыщенном растворе. Она обычно выражается или в процентах, или в граммах растворенного вещества на 100 г растворителя.
Растворимость вещества зависит от температуры. Эта зависимость характеризуется кривыми растворимости. Данные о растворимости некоторых веществ в воде приведены на рис. 1, а также в таблице растворимости.
Согласно этим данным, если, например, приготовить раствор нитрата калия, взяв 100 г воды, насыщенный при 45º, а затем охладить его до 0º, то должно выпасть 60 г кристаллов KNO3. Если соль содержала малые количества других растворимых в воде веществ, насыщение относительно их не будет достигнуто при указанном понижении температуры, а потому они и не выпадут вместе с кристаллами соли. Ничтожные количества примесей, часто не поддающиеся определению обычными методами анализа, могут лишь увлекаться кристаллами осадка. Однако при повторных перекристаллизациях можно получить практически чистое вещество.
Насыщенный раствор соли, который остается после отфильтрования выпавших кристаллов, тем более чистыми они получаются, так как в этом случае они меньше захватывают маточного раствора, содержащего примеси других веществ. Уменьшению примесей содействует промывание кристаллов растворителем после отделения их от маточного раствора.
Таким образом, перекристаллизация сводится к растворению вещества в подходящем растворителе и последующему выделению его из образовавшегося раствора в виде кристаллов. Это один из распространенных методов очистки веществ от примесей.
1.2 Возгонка
Возгонкой, или сублимацией, называется непосредственное превращение твердого вещества в пар без образования жидкости. Достигнув температуры возгонки, твердое вещество без плавления переходит в пар, который конденсируется в кристаллы на поверхности охлажденных предметов. Возгонка всегда происходит при температуре ниже температуры плавления вещества.
Используя свойство ряда веществ (йода, нафталина, бензойной кислоты, нашатыря и др.) возгоняться, легко получить в чистом виде, если примесь лишена этого свойства.
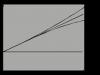
Для более глубокого изучения явления возгонки необходимо познакомится с диаграммой состояния вещества, представленной на рис. 2. На оси абсцисс отложена температура t (в градусах Цельсия) на оси ординат - давление насыщенного пара p (в м/см3). Аналогичный вид имеет диаграмма состояния воды, так что у нее кривая ТВ наклонена к оси ординат, так как температура замерзания воды по мере возрастания давления понижается.
Кривая ТА выражает зависимость между температурой и давлением насыщенного пара над жидкостью. Все точки кривой ТА определяют условия равновесия между жидкостью и ее насыщенным паром. Например, при 100º вода и пар могут существовать только при давлении 760 мм рт. ст. Если давление больше 760 мм рт. ст., то пар конденсируется в воду (область выше кривой ТА); если давление меньше 760 мм рт. ст., то вся жидкость превращается в пар (область ниже кривой ТА). Кривая ТА лежит выше температуры плавления вещества. Кривая ТБ выражает зависимость между температурой и давлением насыщенного пара над твердым телом. Давление пара твердых тел обычно невелико и в значительной степени зависит от природы тела и температуры. Так, давление паров йода при 16º равно 0,15 мм рт. ст., льда при - 15º равно 1,24 мм рт. ст. Кривая ТБ лежит ниже температуры плавления вещества. Все точки этой кривой определяют условия равновесия между твердым телом и его насыщенным паром.
Кривая ТВ называется кривой плавления и выражает зависимость между температурой плавления вещества и давлением.
Все точки этой кривой определяют условия (температуру и давление), при которых твердое вещество и жидкость находятся в равновесии.
Кривые ТА, ТБ и ТВ разделяют диаграмму состояния вещества на три области: 1 - область существования твердой фазы, 2 - жидкой фазы и 3 - парообразной фазы.
Точка Т, где сходятся все три области, указывает температуру и давление, при которых могут находится в равновесии все три фазы вещества - твердая, жидкая и парообразная. Она называется тройной точкой (Т).
Изменяя температуру или давление, можно изменять состояние вещества.
Пусть точка 1 изображает твердое состояние вещества при давлении выше тройной точки. При нагревании вещества при постоянном давлении точка 1 будет двигаться по пунктирной линии 1-4 и при определенной температуре пересечет кривую плавления ТВ в точке 2. Когда все кристаллы расплавятся, дальнейшее нагревание при постоянном давлении приведет в точку 3 на кривой ТА, где начинается кипение жидкости, вещество перейдет в парообразное состояние. При дальнейшем увеличении температуры тело из состояния 3 перейдет в состояние 4. Охлаждение пара повторит рассмотренные процессы в обратном направлении по той же пунктирной кривой из состояния 4 в состояние 1.
Если взять вещество при давлении ниже тройной точки, например в точке 5, то, нагревая вещество при постоянном давлении, достигнем точки 6, в которой твердое вещество будет переходить в пар без предварительного образования жидкости, т.е. будет иметь место возгонка или сублимация (см. пунктирную линию 5-7). Наоборот, при охлаждении пара при томжелавлении произойдет в точке 6 кристаллизация вещества (также без образования жидкости).
Из изложенного можно сделать следующие выводы:
)В результате нагревания твердого вещества при давлении выше тройной точки оно будет плавиться;
)В результате нагревания твердого вещества при давлении ниже тройной точки оно будет возгоняться;
)Если произвести нагревание при атмосферном давлении, то возгонка наступит в том случае, если давление тройной точки данного вещества выше атмосферного. Так, например, при р=1 ат двуокись углерода возгоняется при - 79º, плавиться же будет при условии, что нагревание проводится при давлении более высоком, чем давление тройной точки.
Следует иметь в виду, что твердые вещества могут переходить в пар при давлении выше тройной точки (поскольку все тверды тела и жидкости частично испаряются при всякой температуре). Так, кристаллический йод при атмосферном давлении ниже температуры плавления переходит в пар фиолетовго цвета, который легко конденсируется в кристаллы на холодной поверхности. Это свойство используют для очистки йода. Однако поскольку давление тройной точки у йода ниже атмосферного, то при дальнейшем нагревании он будет плавиться. Поэтомукристаллический йод при атмосферном давлении не может находится в равновесии со своим насыщенным паром.
В равновесии со своим насыщенным паром могут быть лишь твердые вещества, которые находятся под давлением ниже тройной точки. Но пр таком давлении эти вещества не могут плавиться. Возгоняемые вещества можно перевести в жидкое состояние путем нагревания их при определенном давлении.
1.3 Перегонка
Перегонка, или дистилляция, основана на превращении жидкости в пар с последующей конденсацией пара в жидкость. Этим методом отделяют жидкость от растворенных в ней твердых веществ или менее летучих жидкостей. Так, например, с помощью перегонки очищают природную воду от солей, которые в ней содержаться. В результате получается дистиллированная вода, лишенная этих солей или содержащая их лишь в крайне малых количествах.
Для перегонки небольшого количества жидкости в лабораторных условиях применяют приборы для перегонки.
Жидкость закипает тогда, когда давление ее пара сделается равным внешнему давлению (обычно атмосферному). Чистое вещество при постоянном давлении кипит при строго определенной температуре. Смеси кипят при различных (неопределенных) температурах. Поэтому температура кипения является характеристикой чистоты вещества. Вещество тем чище, чем меньше разница между температурой кипения вещества и температурой, при которой оно перегоняется. (1)
С помощью прибора для перегонки можно разделять смеси жидкостей и получать их в чистом виде. Разделение в данном случае основано на различии состава жидкой смеси и ее насыщенного пара. Это хорошо видно из диаграммы рис. 3, на котором показана зависимость температура кипения смеси двух жидкостей (веществ) А и Б от состава жидкой смеси и состава пара, с которым жидкая смесь находится в равновесии. На оси ординат отложены температуры кипения при постоянном давлении, на оси абсцисс - состав жидкой смеси или пара. Начальная точка на оси абсцисс отвечает чистому веществу А (100% вещества А и 0% вещества Б), конечная точка - чистому веществу Б (100% вещества Б и 0% вещества А), промежуточные точки - различным смесям веществ А и Б, например 50% А и 50% Б; 80% А и 20% Б и т.д. Удобства такого способа изображения очевидны. На диаграмме получают две кривые: кривая жидкости (нижняя) выражает состав кипящей жидкости, и кривая пара (верхняя) вырожает состав пара. Как видно, при всех температурах пар имеет иной состав, чем жидкость, т.е. он всегда богаче более летучим компонентом.
Из диаграммы следует, что составу смеси в точке В при температуре кипения t отвечает состав пара в точке Г*, а составу смеси в точке Д при температуре кипения tотвечает состав пара в точке Е, т.е. с увеличением содержания жидкости А в смеси увеличивается содержание А в парах. Это впервые установлено Д.П. Коноваловым в 1881 г.: при повышении концентрации вещества в жидкости увеличивается его содержание в парах (1-й закон Д.П. Коновалова). Поэтому приперегонки такой смеси жидкостей в первых порциях дистиллята будет больше содержаться жидкости с большим давлением пара (т.е. низкокипящей), чем в последующих порциях. В перегонной же колбе в процессе перегонки увеличивается количество высококипящей жидкости.
Такая перегонка, когда дистиллят отбирается при различных интервалах температур и в различные приемники, называется дробной, или фракционной, перегонкой. Жидкости в приемниках, отобранные в определенных интервалах температур, называются фракциями.
Повторяя несколько раз дробную перегонку, можно почти полностью разделить смесь жидкостей и получить компоненты смеси в чистом виде.
Более полному и быстрому разделению смесейжидкостей путем фракционной перегонки благоприятствует применение дефлегматоров или ректификационных колонок. В них частично конденсируется пар до отвода в холодильник, в результате чего в отгоняющийся жидкости сильно увеличивается количество низкокипящей фракции. Одна такая перегонка (т.е. с применением ректификационной колонки или дефлегматора) заменяет несколько последовательных перегонок, осуществляемых с помощью прибора для перегонки.
Перегонка с дефлегматором, а также другие приемы перегонки, как-то: перегонка с паром, перегонка под уменьшенным давлением - рассматриваются в руководствах и практикумах по органической химии.
2. Очистка газа
растворимость вещество перекристаллизация сублимация
Очистка газа от газов-примесей достигается путем пропускания его через такие вещества, которые поглощают эти примеси. Например, при получении в приборе Киппа двуокиси углерода вместе с ней выходят примеси - хлористый водород (от соляной кислоты) и пары воды. Если двуокись углерода с этими примесями пропустить сначала через промывалку с водой (для поглощения хлористого водорода), а затем через хлоркальциевую трубку (для поглощения паров воды), то СО2 получится практически чистой.
Для определения степени чистоты вещества применяются физические и химические методы исследования. К первым относятся: для жидких веществ - определение плотности, температуры кипения, показателя преломления; для твердых веществ - определение температуры плавления и ряд других; ко вторым методам относятся химические анализы - качественный и количественный - на содержание примесей.
Абсолютно чистых веществ нет. Применяемые в лабораторной практике вещества имеют различную степень чистоты. Максимально допустимое количество примесей в веществе устанавливается общесоюзным стандартом (ГОСТом).
Для лабораторных работ по неорганической химии и качественному анализу пригодны вещества с маркировкой х.ч. (содержат 10-5 - 10-7% примесей) и ч. д. а. (содержат около 10-4% примесей).
Новая техника потребовала применения веществ особой чистоты - ультрачистых или особо чистых - с содержанием примесей порядка 10-5 - 10-7%. Для получения их применяются специальные методы очистки. Так, для глубокой очистки полупроводниковых материалов широко используется метод зонной плавки, основанный на неодинаковом распределении примесей между жидкой и твердой фазами вследствие их неодинаковой растворимости. Этим методом удается получить германий с содержанием основного элемента не менее 99,99999%.
Методы получения особо чистых веществ рассматриваются в специальной литературе.
3. Специальные методы очистки веществ
3.1 Диализ
Диализ может быть использован для разделения и очистки веществ, растворенных в воде или в органическом растворителе. Этим приемом чаще всего пользуются для очистки высокомолекулярных веществ, растворенных в воде, от примесей низкомолекулярных или от неорганических солей. (2)
Для очистки методом диализа необходимы так называемые полупроницаемые перегородки, или мембраны» Особенность их заключается в том, что они имеют поры, позволяющие проходить через них веществам, размер молекул или ионов которых меньше размеров пор, и задерживать вещества, размеры молекул или ионов которых больше размеров пор мембраны. Таким образом, диализ можно рассматривать как особый случай фильтрования.
Рис. 4. Диализатор с мешалкой.
В качестве полупроницаемых перегородок или мембран могут быть использованы пленки из очень многих высокомолекулярных и высокополимерных веществ. В качестве мембран применяют пленки из желатина, из альбумина, пергамент, пленки из гидратцел-люлозы (типа целлофана), из эфпров целлюлозы (ацетат, пи грат н пр.), из многих продуктов полимеризации п конденсации. Из неорганических веществ находят применение: иеглазуроваииый фарфор, плитки из некоторых сортов обожженной глины (типа коллоидных глин, как бентонит), прессованное мелкопористое стекло, керамика и др.
Основными требованиями к мембранам являются: 1) нерастворимость в том растворителе, на котором приготовлен диализируемый раствор; 2) химическая инертность по отношению как к растворителю, так и к растворенным веществам; 3) достаточная механическая прочность.
Многие мембраны способны набухать в воде или другом растворителе, теряя при этом механическую прочность. Набухшая пленка может быть легко повреждена или разрушена. В подобных случаях пленку для диализа изготовляют на какой-нибудь прочной основе, например на ткани, инертной к растворителю (хлопчатобумажная, шелковая, из стекловолокна, из синтетического волокна и др.), или па фильтровальной бумаге. Иногда для придания мембранам механической прочности их укрепляют металлическими сетками (армирование) из соответствующего металла (бронза, платина, серебро и пр.).
Для получения различной пористости у мембран из эфиров целлюлозы или из некоторых других высокополимерных веществ в соответствующие лаки вводят различное количество воды. При высыхании лаковой пленки получается мембрана молочного цвета, имеющая заданную пористость (об этом см. гл. 9 «Фильтрование»).
Для диализа применяют приборы называемые диализаторами (рис. 4). Они могут иметь различную конструкцию. Техника работы с диализаторами очень проста. Полупроницаемая мембрана разделяет прибор обычно на две части. В одну половину прибора наливают раствор, подлежащий диализу, а в другую половину - чистый растворитель, причем последний обычно обновляют (постоянный ток жидкости). Если чистый растворитель не менять, то концентрации проходящих через мембрану веществ с обеих сторон ее в конце концов уравновесятся и диализ практически остановится. Если же растворитель все время обновлять, то из диализируемого раствора можно практически удалить все растворимые вещества, способные проникать через мембрану.
Скорость диализа неодинакова для различных веществ и зависит от ряда условий и свойств вещества, которое очищают. Повышение температуры раствора и обновление растворителя способствуют ускорению диализа.
Во многих случаях вместо обычного диализа применяют электродиализ. Применение электрического тока при диализе ускоряет процесс и создает ряд других преимуществ.
Осаждение малорастворимых веществ. Этим приемом широко пользуются для аналитических целей, получая осадки, содержащие только какое-нибудь одно, неорганическое или органическое, вещество. Полученный осадок может быть дополнительно очищен или промыванием («Фильтрование», или повторным переосаждением после растворения осадка, или экстрагированием соответствующими растворителями в определенных для каждого случая условиях.
Аппаратура, применяемая для проведения этого метода, зависит от свойств веществ и свойств растворителей. Часто операцию можно проводить просто в стакане или в колбе. В других же случаях собирают герметизированную аппаратуру, подобную той, которая описана в гл. 10 «Растворение». Осадки отфильтровывают, промывают и затем подвергают дальнейшей обработке (перекристаллизации, сушке и т. д.).
Отделение малора«гворимого осадка от маточного раствора можно достичь отстаиванием с последующим промыванием осадка с применением декантации или центрифугирования. Чем продолжительнее отстаивание, тем больше уплотняется слой осадка. Однако не рекомендуется давать осадкам отстаиваться слишком долго, так как со временем между осадком и маточным раствором могут возникать побочные процессы (адсорбция других ионов, комп-лексообразование с растворителем), затрудняющие последующую "обработку отделяемого осадка.
3.2 Комплексообразование
Комплексообразование является одним из приемов выделения чистых веществ, особенно неорганических. Комплексные соединения могут быть или труднорастворимыми в воде, но легкорастворимыми в органических растворителях, или наоборот. В первом случае осадки обрабатывают, как описано выше. Если же комплексное соединение легко растворяется в воде, его можно извлечь в чистом виде из водного раствора путем экстрагирования подходящим органическим растворителем или же разрушить комплекс тем или иным путем. (3)
Приемом комплексообразования можно выделить металлы в очень чистом виде. Это особенно касается редких и рассеянных металлов, которые могут быть выделены в виде комплексов с органическими веществами.
Образование летучих соединений. Этим приемом можно пользоваться в том случае, если образуется летучее соединение только выделяемого вещества, например какого-либо металла. В том случае, если одновременно образуются летучие соединения примесей, этот прием применять не рекомендуется, так как освобождение от летучих примесей может оказаться затруднительным. Во многих случаях образование летучих галогенидов (хлористые или фтористые соединения) некоторых веществ может оказаться очень эффективным как метод очистки, особенно в сочетании с вакуум-перегонкой. Чем ниже температура возгонки или кипения интересующего нас вещества, тем легче его отделить от других и очистить фракционной перегонкой или диффузией.
Скорость диффузии газообразных веществ через полупроницаемые перегородки зависит от плотности и молекулярной массы очищаемого вещества и почти обратно пропорциональна им,
3.3 Зонная плавка
Зонную плавку можно рассматривать как частный случай экстракции расплавленным веществом, когда твердая фаза вещества находится в равновесии с его жидкой фазой. Если растворимость в жидкой фазе какой-либо примеси, содержащейся в очищаемом веществе, отличается от растворимости в твердой фазе, то очистка от этой примеси теоретически возможна *. Этот метод особенно ценен для очистки таких соединений (преимущественно органических), которые имеют низкое давление паров или разлагаются при перегонке. (4) Для соединений, имеющих низкую теплопроводность, зону плавления можно создать, применяя высокочастотный нагрев с диэлектрическим сопротивлением. Метод зонной плавки дает возможность полностью использовать исходные вещества и позволяет получать большие монокристаллы органических веществ и некоторых металлов (например, алюминия, германия и др.).
В простейшей форме метод зонной плавки в применении к металлам состоит в медленном перемещении расплавленной зоны вдоль стержня из металла.
Метод зонной плавки может найти широкое применение для приготовления чистых органических соединений. (5)
В настоящее время делаются попытки применить метод зонной плавки для очистки жидкостей. Этот метод оказался применим для"очистки только предварительно замороженной жидкости. Для этого жидкость помещают в узкую и длинную стеклянную лодочку (шириной 12 мм, длиной 110 мм) и замораживают при -30° С, с помощью циркуляционного охлаждающего устройства, работающего на смеси твердой углекислоты с ацетоном. Замороженную жидкость в лодочке медленно протягивают с помощью моторчика Уоррена со скоростью 1 см/ч через несколько последовательных зонных нагревателей, расположенных на расстоянии около 1,8 см друг от друга и представляющих собой витки нихро.мовой проволоки диаметром 0,5 мм (0,5 ом/м) в пазах небольших керамических блоков. Силу тока подбирают такой, чтобы температура расплавленных узких зон в замороженной жидкости была 3--4° С. Расплавленные зоны, перемещаясь одна за другой, увлекают за собой примеси, имевшиеся в жидкости. Примеси концентрируются в конечной части бруска замороженной жидкости. Таким приемом можно очищать водные и неводные растворы и выделять растворенные или только тонко диспергированные вещества. (6)
Аппаратурное оформление метода зонной плавки зависит от свойств взятых веществ, и рекомендовать какую-либо стандартную аппаратуру в этом случае трудно. (7)
3.4 Хроматография
Метод хроматографии особенно важен для концентрирования веществ, содержание которых в исходном растворе очень мало, а также для получения чистых препаратов. При помощи этого метода были получены редкоземельные и заураповые элементы высокой чистоты. Многие фармацевтические и органические препараты очищают и получают в чистом виде при помощи этого метода. Почти во всех случаях, когда поставлена задача очистки или отделения какого-либо вещества из смеси, находящейся в растворе, хроматография и ионный обмен могут оказаться надежными методами.
Для ионного обмена применяют так называемые иониты, представляющие собой неорганические или органические адсорбенты (преимущественно смолы разных марок). По своим химическим свойствам они разделяются на следующие группы: катнониты, ани-ониты и амфолиты. Катиониты обменивают катионы. Аниониты обладают способностью обменивать анионы. Амфожгты способны обменивать как катионы, так и анионы-в зависимости от рН среды и свойств вещества, которое должно быть поглощено ионитом. (8)
Иониты способны к ионному обмену до полного насыщения их поглощаемым ионом. Отработанные иониты регенерируют путем промывания катионитов кислотой, анионитов-щелочами.* В элюате (жидкость, получаемая при промывании ионита) будут находиться адсорбируемые ионитом ионы.
Для разделения и фракционирования полимеров предложен способ фильтрации их растворов через гель, названный «сефадекс» (Швеция). Этот способ называют г е л ь - ф и л ь т р а ц и е й. По существу он является хроматографическим разделением высокомолекулярных веществ на колонке.
Сефадекс выпускается в виде мелких зерен, набухающих в воде. (9)
При использовании других веществ границы молекулярных весов могут отклоняться от приведенных значений в ту или иную сторону. Так, для белковых веществ диапазоны молекулярных весов шире, чем в случае полисахаридов. Для использования сефадекса сконструирована хро-матографическая колонка с рубашкой; колонка выполнена из боросиликатного стекла. (10)
Вначале сефадекс смешивают с водой, взмучивают полученную смесь, вливают в колонку и дают осесть. Затем в колонку добавляют концентрированный раствор исследуемого вещества так, чтобы не взмучивался верхний слой сефадекса. Равновесие устанавливается очень быстро, поэтому скорость вымывания по сравнению с обычными иопитами может быть большой. Фракции контролируют или спектрофотометрически (органические полимеры), или по электропроводности (растворы неорганических веществ). Метод гель-фильтрования полностью заменяет диализ и электродиализ. При его помощи можно очень тонко фракционировать полимеры, которые мало отличаются между собой по молекулярным массам.
4. Экспериментальная часть
Очистка медного купороса перекристаллизацией
Пользуясь таблицей растворимости сульфата меди (приложение №1), вычислить, сколько воды и медного купороса надо взять для приготовления такого количества насыщенного при 80ºС раствора соли, из которого при последующем охлаждении до 0ºС выделилось бы 10г CuSO4·5H2O.
Медный купорос загрязнен небольшим количеством хлорида калия, а также нерастворимыми примесями (песок, кусочки угля). Поэтому его нужно взять на 10% больше вычисленного.
Отмерить цилиндром вычисленный объем дистиллированной воды, вылить в микро стакан емкостью 50мл, нагреть до начала кипения и растворить при помешивании стеклянной палочкой навеску медного купороса.
Убедится, что в приготовленном растворе содержаться хлорид-ионы. Для этого в коническую пробирку налить 3 капли раствора, добавить 1 каплю раствора AgNO3 и 2 капли азотной кислоты. Выпадает белый осадок.
После испытания на хлорид-ион нагретый до кипения раствор медного купороса отфильтровать через воронку для горячего фильтрования, изображенную на рис. 4 (отделение нерастворимых примесей). Насыщенный раствор при таком фильтровании не будет охлаждаться, а значит вещество не будет кристаллизоваться на фильтре и тем самым затруднять процесс фильтрования. Воронка нагревается включением электрического тока.
Для ускорения фильтрования рекомендуется применять складчатый фильтр, который должен быть приготовлен заранее. Метод изготовления гладких (простых) фильтров виден из рис. 5. Складчатый фильтр (рис. 6) изготовляют следующим образом: сначала делают гладкий фильтр большого размера, затем складывают его пополам и каждую половину сгибают несколько раз в одну и другую сторону, подобно гармонике. Фильтр не должен доходить до краев воронки на 5 - 10 мм.
Помешивая фильтрат стеклянной палочкой, охладить его сперва до комнатной температуры, а потом до 0ºС (в кристаллизаторе с водой и льдом).
Выпавшие кристаллы соли отделить от маточного раствора фильтрованием. Лучше всего фильтрование проводить при пониженном давление на воронке Бюхнера. Это сильно ускоряет процесс фильтрования. Воронку Бюхнера с резиновой пробкой вставляют в колбу Бюнзена (толстостенная колба с отростком). На пластинку воронки с порами кладут кружок фильтровальной бумаги, которую смачиваю водой для более плотного прилегания к пластине, наполняют воронку фильтруемым раствором, а боковой отросток соединяют с водяным насосом. Фильтрование с помощью воронки Бюхнера показано на рис. 7.
Снять кристаллы соли с воронки и отжимать их между листками фильтровальной бумаги до тех пор, пока они не перестанут прилипать к сухой стеклянной палочке. Взвесить на технохимических весах полученную соль. Определить в процентах выход соли, принимая вычисленное количество CuSO4·5H2O, которое теоретически должно было выделиться, за 100%.
Раствор очищенной соли и маточный раствор испытать на присутствие хлорид-иона.
4.1 Пример решения задачи
Сколько граммов воды и медного купороса нужно взять для приготовления такого количества насыщенного при 80ºС раствора, который при охлаждении до 0ºС выделит 5г медного купороса?
Решение: Из таблицы растворимости (приложение 1) находим, что в 100г насыщенного раствора нужно взять x г CuSO4·5H2O. Если при 0ºС выпадает 5г медного купороса, то в растворе останется (x-5)г. В пересчете на безводную соль это составит (x - 5) : или г. Вычисляем количество раствора, содержащее
г соли:
12,9 г безводной соли содержаться в 100г раствора
a = г.
При нагревании до 80? С получаем насыщенный раствор, в количестве
В нем будет содержаться медного купороса
Это количество равно x. Тогда
Отсюда x=25,3г.
При 80? С вычисленное количество соли будет насыщать
г раствора
Воды необходимо взять
46,5 г - 25,3 г = 21,2 г, или 21,2 мл.
Эту задачу решить иным путем, сделав предварительный расчет количества соли, приходящейся на одно и то же количество воды.
9 г CuSO4соответствуют 34,9?1,56=54,44 г CuSO4?5H2O, а 12,9 г CuSO4 - 20,12CuSO4?5H2O. В насыщенном растворе:
При 80? С на 54,44 г CuSO4?5H2O приходится 45,56 г H2O
С20,12 CuSO4?5H2O79,88 H2O
СXCuSO4?5H2O45,56 H2O
При охлаждении раствора от 80 до 0? С получим:
44 - 11,47 = 42,97 г медного купороса.
Количество воды и соли находим из соотношения:
97 г CuSO4?5H2O - 45,56 г H2O
5 CuSO4?5H2O - yH2O
42,97 г CuSO4?5H2O выпадает в осадок из 54,44 г CuSO4?5H2O
5 CuSO4?5H2OzCuSO4?5H2O
Можно и так:
гCuSO4?5H2O соответствует CuSO4. Пусть при 80? С надо взять x г CuSO4 вyг раствора. Тогда
При 0?С после выпадения 5 гCuSO4?5H2O или 12,82 CuSO4вес xуменьшится на 12,82 г. Останется (x - 12,82)г CuSO4 в (y - 20) г раствора. Значит
Но x=0,349y.
Тогда Откуда y=46,54 г раствора. X = 0,349?46,54г = 16,24 г CuSO4или 25,3 г CuSO4?5H2O. Воды надо взять: 46,54 г - 25,33 г = 21,2 г или 21,2 мл.
Заключение
В данной курсовой были рассмотрены одни из самых используемых способов очистки веществ в химии (перекристаллизация, возгонка, перегонка и др.).
Эти методы достаточно эффективны и часто применимы, их плюс заключается в дешевизне оборудования необходимого для работы и скорости проведения очистки, но у всех них есть один недостаток, ни одним из предложенных способов нельзя получить сверх чистое вещество.
Наша наука не стоит на месте и находятся новые методы очистки веществ с помощью более сложного и точного оборудования. В данной работе были рассмотрены хроматография, диализ, комплексообразование и др. С помощью этих методов мы можем получить сверх чистое вещество. Но они все еще остаются дорогостоящими и ни один из них не является универсальным.
Тема очистки веществ будет оставаться актуальной, так как постоянно будут разрабатываться новые способы получения сверх чистых веществ, которые все более востребованы в промышленности и научных опытах.
Список использованных источников и литературы
1.Пфаин В. Дж. Зонная плавка/ В. Дж. Пфаин - М. : Металлургиздат, 1960. - 384 с.
2.Херингтон E. Зоиная плавка органических веществ / Е. Херингтон; пер. с англ. - М. : Мир, 1965. - 547 с.
Абакумов Б. И. Установка для зонной плавки / Б. И. Абакумов, Э. Е. Коновалов. - М. : РЖХим, 1964, 367 с.
Шплкин А. И. Установку для бестигельной зонной плавки веществ с малым поверхностным натяжением / И. А. Шплкин, А. А. Ки-лиев. - М. : РЖХим, 1964. - 230 с.
Муссо H. О новых методах разделения в химии / Н. Муссо; пер. с англ. -М. : РЖХим, 1958. - 654 с.
Линстед Р. О хроматографических методах очистки и выделения веществ / Р. Линстед; пер. с англ. - М. : Издатинлит, 1959. - 476 с.
Горшков В. И. / И. В. Горшков, В. А. Федоров, А. М. Толмачев. - М. : РЖХим, 1966. - 187 с.
Нийсел В. О методе разделения растворенных веществ, основанном на различии в скоростях диффузии / В. Нийсел; пер. с англ. - М. : РЖХим, 1964. - 479 с.
Шилд-Кнетч H. Разделения кристаллизующихся веществ / Н. Шилд-Кнетч; пер. с англ. - М. : РЖХим, 1964. - 169 с.
Малей Л. Применение хроматографии, основанной на проникновении вещества в гель, к веществам с низким и высоким молекулярным весом / Л. Малей; пер. с англ. - М. : РЖХим, 1965. - 540 с.
Некоторые твердые вещества при нагревании способны активно испаряться до достижения температур их плавления. Обратный переход паров в твердое состояние происходит сразу, минуя жидкую фазу. Такой процесс называется возгонкой или сублимацией и применяется для очистки веществ.
Возгонка, даже однократная, как правило, приводит к получению вполне чистого продукта и нередко заменяет несколько перекристаллизации. Она может быть использована как для окончательной очистки продукта, так и для предварительного отделения летучего соединения от нелетучих примесей. От перекристаллизации возгонка выгодно отличается также более высоким выходом чистого продукта (98-99%).
С другой стороны, возгонка - весьма длительный процесс, поэтому его обычно используют для очистки небольших количеств веществ. Область применения этого метода ограничена также тем, что способность многих твердых соединении сублимироваться столь ничтожна, что не может быть использована для препаративных целей.
Поскольку скорость испарения пропорциональна общей площади поверхности испарения, подвергаемое возгонке вещество необходимо как можно тоньше измельчать. Не следует также допускать плавления вещества при возгонке, поскольку это ведет к падению скорости процесса вследствие резкого уменьшения поверхности вещества.
Применение разрежения, так же как и при перегонке, снижает температуру, при которой вещества начинают возгоняться, поэтому под вакуумом удается сублимировать многие трудполетучие соединения.
При выборе приборов для возгонки следует отдавать предпочтение конструкциям, в которых расстояние между возгоняемым веществом и поверхностью конденсации минимально. С уменьшением этого расстояния возрастает скорость возгонки.
Рис. 81. Приборы (а, б) для возгонки с конденсацией паров на охадаемых поверхностях.

Рис. 82. Простейший прибор для возгонки: 1 - фарфоровая чашка с веществом; 2 - стеклянная воронка; 3- кружок фильтровальной бумаги с отверстиям; 4 - песчаная баня; 5 - вата.
Для сублимации небольших количеств легко возгоняющихся веществ может быть использован про- стсйшпй прибор, состоящий кз фарфоровой чашки, часового стекла и обычной химической воронки (рис. 80). Возгоняемое вещество нагревают на песчаной бане; возгон собирается на холодных стенках воронки, откуда его следует периодически счищать. Чтобы кристаллы возгона не падали обратно в чашку, вещество накрывают кружком фильтровальной бумаги или асбеста, проколов в нем несколько отверстий.

Рис. 82. Прибор для возгонки небольших количеств веществ в вакууме.
Во многих случаях предпочтительнее проводить конденсацию на охлаждаемую поверхность. Из всех предложенных для этой цели приборов наиболее простыми и в то же время обеспечивающими минимальное расстояние до поверхности конденсации являются приспособления, изображенные на рис. 81.
Обычно применяемый прибор для возгонки небольших количеств веществ в вакууме приведен на рис. 82. К его недостаткам относится необходимость периодического отключения вакуума и разборки прибора для соскабливания возгона.
В вакуум-сублиматоре, изображенном на рис. 83, возгон собирается в горизонтально расположенном холодильнике с достаточно широкой внутренней трубкой. Во избежание преждевременной конденсации продукта колбу с возгоняемым веществом по самое горло погружают в нагретую до нужной температуры жидкостную баню. Небольшой ток воздуха или инертного газа, подаваемый в" колбу через капилляр, способствует эффективному отводу паров от поверхности испарения, что резко повышает производительность прибора.
Для предотвращения уноса мельчайших частиц вещества с током газа в отводное горло колбы целесообразно впаять пористую стеклянную перегородку, однако при небольшом расходе газа эта мера не обязательна.

В зависимости от свойств очищаемого вещества и его количества можно изменять конструкцию отдельных частей прибора, не меняя принципа его действия. Так, различными могут быть форма колбы и способ ее обогрева. В качестве конденсатора для сублимации больших количеств вещества очень удобна охлаждаемая снаружи двухгорлая колба.
В лабораторной практике чаще всего применяются следующие методы очистки веществ: перекристаллизация, возгонка и поглощение. Для очистки твёрдых веществ применяется перекристаллизация и возгонка, для очистки газов – поглощение газов-примесей различными веществами.
Перекристаллизация
Очистка перекристаллизацией основывается на изменении растворимости вещества с изменением температуры. Под растворимостью понимают содержание (концентрацию) растворённого вещества в насыщенном растворе. Она обычно выражается или в процентах, или в граммах растворённого вещества на 100 г растворителя. Данные о растворимости некоторых соединений в воде при различной температуре приведены на рис. 2.1 и в приложении. Небольшие количества примесей, часто не поддающиеся определению обычными методами анализа, механически не могут увлекаться кристаллами осадка. При повторных перекристаллизациях можно получить практически чистое вещество. Насыщенный раствор соли, который остаётся после отфильтровывания выпавших кристаллов называется маточным. Чем меньше по размеру выпавшие кристаллы, тем более чистыми они получаются, так как в этом случае они меньше захватывают маточного раствора, содержащего примеси других веществ. Уменьшению этих примесей содействует промывание кристаллов растворителем после отделения их от маточного раствора.
Рис. 2.1. Кривые растворимости
Возгонка
Возгонкой или сублимацией называется непосредственное превращение твёрдого вещества в пар без образования жидкости. Достигнув температуры возгонки, твёрдое вещество без плавления переходит в пар, который конденсируется в кристаллы на поверхности охлаждённых предметов. Возгонка всегда происходит при температуре ниже температуры плавления вещества.
Используя способность ряда вещества (йода, нафталина, бензойной кислоты, нашатыря и др.) к возгонке, легко получить их в чистом виде (если примесь не возгоняется).
В технике и лабораториях возгонка проводится не только при атмосферном, но и при пониженном давлении (вакууме).
Перегонка
Перегонка или дистилляция основана на превращении жидкости в пар с последующей конденсацией пара в жидкость. Этим методом отделяют жидкость от растворённых в ней твёрдых веществ или менее летучих жидкостей. Так, например, с помощью перегонки очищают воду от солей, которые в ней содержатся. В результате получается дистиллированная вода.
Для перегонки небольших количеств жидкости в лабораторных условиях применяют прибор для перегонки (рис. 2.2).
Жидкость закипает тогда, когда давление её пара становится равным внешнему давлению (обычно атмосферному). Чистое вещество при постоянном давлении кипит при строго определённой температуре. Смеси кипят при различных температурах, зависящих от состава. Поэтому температура кипения является характеристикой чистоты вещества. Чем чище вещество, тем меньше разница между температурой кипения вещества и температурой перегонки, при которой оно перегоняется.

Рис. 2.2. Установка для перегонки:
1 – колба Вюрца, 2 – холодильник Либиха, 3 – аллонж, 4 – приёмник
Перегонка, когда дистиллят отбирается при различных интервалах температур и в различных приёмниках, называется дробной или фракционной перегонкой. Жидкости в приёмниках, отобранные в определённых интервалах температур, называются фракциями. Повторяя несколько раз дробную перегонку, можно почти полностью разделить смесь жидкостей и получить компоненты смеси в чистом виде.
Более полному и быстрому разделению смеси жидкостей путём фракционной перегонки благоприятствует применение дефлегматоров или ректификационных колонок. Перегонка с дефлегматором, а также другие приёмы перегонки, как-то: перегонка под уменьшенным давлением – рассматриваются в руководствах и практикумах по органической химии.
Очистка газов
Очистка газов от примесей достигается путём пропускания его через такие вещества, которые поглощают эти примеси. Например, для получения в приборе Киппа углекислого газа наряду с CO 2 выходят примеси: хлористый водород (от соляной кислоты) и пары воды. Если углекислый газ с примесями пропустить сначала через промывалку с водой (для поглощения хлористого водорода), а затем через серную кислоту (для поглощения паров воды), то он получится практически чистым.
Для определения степени чистоты вещества применяются физические и химические методы исследования. К первым относятся: для жидких веществ – определение плотности, температуры кипения, показателя преломления; для твёрдых веществ – определение температуры плавления и ряд других, к вторым методам относятся химические качественные и количественные анализы на содержание примесей.
Абсолютно чистых веществ нет. Применяемые в лабораторных практикумах вещества имеют различную степень чистоты. Максимально допустимое количество примесей в веществе устанавливается государственным стандартом (ГОСТ).
Для лабораторных работ по общей химии и качественному анализу пригодны вещества с маркировкой х.ч. и ч.д.а.