|
Сходство ферментов и
|
Отличие ферментов от неорганических катализаторов |
|
1. Ускоряют только термодинамически возможные реакции |
1. Для ферментов характерна высокая специфичность: субстратная специфичность : ▪ абсолютная (1 фермент - 1 субстрат), ▪ групповая (1 фермент – несколько похожих субстратов) ▪ стереоспецифичность (ферменты работают с субстратами только определенного стереоряда L или D). каталитическая специфичность (ферменты катализируют реакции преимущественно одного из типов химических реакций – гидролиза, окисления-восстановления и др) |
|
2. Не изменяют состояние равновесия реакций, а только ускоряют его достижение. |
2. Высокая эффективность действия: ферменты ускоряют реакции в10 8 -10 14 раз. |
|
3. В реакциях не расходуются |
3. Ферменты действуют только в мягких условиях (t = 36-37ºС, рН ~ 7,4, атмосферное давление), т.к. они обладают конформационной лабильностью – способностью к изменению конформации молекулы под действием денатурирующих агентов (рН, Т, химические вещества). |
|
4. Действуют в малых количествах |
4. В организме действие ферментов регулируется специфически (катализаторы только неспецифически) |
|
5. Чувствительны к активаторам и ингибиторам |
5. Широкий диапазон действия (большинство процессов в организме катализируют ферменты). |
В настоящее время учение о ферментах является центральным в биохимии и выделено в самостоятельную науку – энзимологию . Достижения энзимологии используются в медицине для диагностики и лечения, для изучения механизмов патологии, а, кроме того, и в других областях, например, в сельском хозяйстве, пищевой промышленности, химической, фармацевтической и др.
Строение ферментов
Метаболит - вещество, которое участвует в метаболических процессах.
Субстрат – вещество, которое вступает в химическую реакцию.
Продукт – вещество, которое образуется в ходе химической реакции.
Ферменты характеризуются наличием специфических центров катализа.
Активный центр (Ац) – это часть молекулы фермента, которая специфически взаимодействует с субстратом и принимает непосредственное участие в катализе. Ац, как правило, находиться в нише (кармане). В Ац можно выделить два участка: участок связывания субстрата – субстратный участок (контактная площадка) и собственно каталитический центр .
Большинство субстратов образует, по меньшей мере, три связи с ферментом, благодаря чему молекула субстрата присоединяется к активному центру единственно возможным способом, что обеспечивает субстратную специфичность фермента. Каталитический центр обеспечивает выбор пути химического превращения и каталитическую специфичность фермента.
У группы регуляторных ферментов есть аллостерические центры , которые находятся за пределами активного центра. К аллостерическому центру могут присоединяться “+” или “–“ модуляторы, регулирующие активность ферментов.
Различают ферменты простые, состоят только из аминокислот, и сложные, включают также низкомолекулярные органические соединения небелковой природы (коферменты) и (или) ионы металлов (кофакторы).
Коферменты – это органические вещества небелковой природы, принимающие участие в катализе в составе каталитического участка активного центра. В этом случае белковую составляющую называют апоферментом , а каталитически активную форму сложного белка – холоферментом . Таким образом: холофермент = апофермент + кофермент.
В качестве коферментов функционируют:
нуклеотиды,
коэнзим Q,
Глутатион
производные водорастворимых витаминов:
Кофермент, который присоединен к белковой части ковалентными связями называется простетической группой . Это, например, FAD, FMN, биотин, липоевая кислота. Простетическая группа не отделяется от белковой части. Кофермент, который присоединен к белковой части нековалентными связями называется косубстрат . Это, например, НАД + , НАДФ + . Косубстрат присоединяется к ферменту в момент реакции.
Кофакторы ферментов – это ионы металлов, необходимые для проявления каталитической активности многих ферментов. В качестве кофакторов выступают ионы калия, магния, кальция, цинка, меди, железа и т.д. Их роль разнообразна, они стабилизируют молекулы субстрата, активный центр фермента, его третичную и четвертичную структуру, обеспечивают связывание субстрата и катализ. Например, АТФ присоединяется к киназам только вместе с Mg 2+ .
Изоферменты – это множественные формы одного фермента, катализирующие одну и ту же реакцию, но отличающие по физическим и химическим свойствам (сродству к субстрату, максимальной скорости катализируемой реакции, электрофоретической подвижности, разной чувствительности к ингибиторам и активаторам, оптимуму рН и термостабильности). Изоферменты имеют четвертичную структуру, которая образована четным количеством субъединиц (2, 4, 6 и т.д.). Изоформы фермента образуются в результате различных комбинаций субъединиц.
В качестве примера можно рассмотреть лактатдегидрогеназу (ЛДГ), фермент, который катализирует обратимую реакцию:
НАДН 2 НАД +
пируват ← ЛДГ → лактат
ЛДГ существует в виде 5 изоформ, каждая из которых состоит из 4-х протомеров (субъединиц) 2 типов М (muscle) и Н (heart). Синтез протомеров М и Н типа кодируется двумя разными генетическими локусами. Изоферменты ЛДГ различаются на уровне четвертичной структуры: ЛДГ 1 (НННН), ЛДГ 2 (НННМ), ЛДГ 3 (ННММ), ЛДГ 4 (НМММ), ЛДГ 5 (ММММ).
Полипептидные цепи Н и М типа имеют одинаковую молекулярную массу, но в составе первых преобладают карбоновые аминокислоты, последних – диаминокислоты, поэтому они несут разный заряд и могут быть разделены методом электрофореза.
Кислородный обмен в тканях влияет на изоферментный состав ЛДГ. Где доминирует аэробный обмен, там преобладают ЛДГ 1 , ЛДГ 2 (миокард, надпочечники), где анаэробный обмен - ЛДГ 4 , ЛДГ 5 (скелетная мускулатура, печень). В процессе индивидуального развития организма в тканях происходит изменение содержания кислорода и изоформ ЛДГ. У зародыша преобладают ЛДГ 4 , ЛДГ 5 . После рождения в некоторых тканях происходит увеличение содержания ЛДГ 1 , ЛДГ 2 .
Существование изоформ повышает адаптационную возможность тканей, органов, организма в целом к меняющимся условиям. По изменению изоферментного состава оценивают метаболическое состояние органов и тканей.
Локализация и компартментализация ферментов в клетке и тканях .
Ферменты по локализации делят на 3 группы:
I – общие ферменты (универсальные)
II - органоспецифические
III - органеллоспецифические
Общие ферменты обнаруживаются практически во всех клетках, обеспечивают жизнедеятельность клетки, катализируя реакции биосинтеза белка и нуклеиновых кислот, образование биомембран и основных клеточных органелл, энергообмен. Общие ферменты разных тканей и органов, тем не менее, отличаются по активности.
Органоспецифичные ферменты свойственны только определенному органу или ткани. Например: Для печени – аргиназа. Для почек и костной ткани – щелочная фосфатаза. Для предстательной железы – КФ (кислая фосфатаза). Для поджелудочной железы – α-амилаза, липаза. Для миокарда – КФК (креатинфосфокиназа), ЛДГ, АсТ и т.д.
Внутри клеток ферменты также распределены неравномерно. Одни ферменты находятся в коллоидно-растворенном состоянии в цитозоле, другие вмонтированы в клеточных органеллах (структурированное состояние).
Органеллоспецифические ферменты . Разным органеллам присущ специфический набор ферментов, который определяет их функции.
Органеллоспецифические ферменты это маркеры внутриклеточных образований, органелл:
Клеточная мембрана: ЩФ (щелочная фосфатаза), АЦ (аденилатциклаза), К-Nа-АТФаза
Цитоплазма: ферменты гликолиза, пентозного цикла.
ЭПР: ферменты обеспечивающие гидроксилирование (микросомальное окисление).
Рибосомы: ферменты обеспечивающие синтез белка.
Митохондрии: ферменты окислительного фосфорилирования, ЦТК (цитохромоксидаза, сукцинатдегидрогеназа), β-окисления жирных кислот.
Ядро клетки: ферменты обеспечивающие синтез РНК, ДНК (РНК-полимераза, НАД-синтетаза).
Ядрышко: ДНК-зависимая-РНК-полимераза
В результате в клетке образуются отсеки (компартменты), которые отличаются набором ферментов и метаболизмом (компартментализация метаболизма).
Среди ферментов выделяется немногочисленная группа р егуляторных ферментов, которые способны отвечать на специфические регуляторные воздействия изменением активности. Эти ферменты имеются во всех органах и тканях и локализуются в начале или в местах разветвления метаболических путей.
Строгая локализация всех ферментов закодирована в генах.
Определение в плазме или сыворотке крови активности органо- органеллоспецифических ферментов широко используется в клинической диагностике.
Классификация и номенклатура ферментов
Номенклатура – названия индивидуальных соединений, их групп, классов, а также правила составления этих названий. Номенклатура ферментов бывает тривиальной (короткое рабочее название) и систематической. По систематической номенклатуре, принята в 1961г Международным союзом биохимии, можно точно идентифицировать фермент и его катализируемую реакцию.
Классификация – разделение чего либо по выбранным признакам.
Классификация ферментов основана на типе катализируемой химической реакции;
На основании 6 типов химических реакций ферменты, которые их катализируют, подразделяют на 6 классов, в каждом из которых несколько подклассов и поподклассов (4-13);
Каждый фермент имеет свой шифр КФ 1.1.1.1. Первая цифра обозначает класс, вторая - подкласс, третья - подподкласс, четвертая - порядковый номер фермента в его подподклассе (в порядке открытия).
Название фермента состоит из 2 частей: 1 часть – название субстрата (субстратов), 2 часть – тип катализируемой реакции. Окончание – АЗА;
Дополнительная информация, если необходима, пишется в конце и заключается в скобки: L-малат + НАДФ+ ↔ ПВК + СО 2 + НАДН 2 L-малат: НАДФ+ - оксидоредуктаза (декарбоксилирующая);
В правилах названия ферментов нет единого подхода.
Ферменты - это специализированные белки, образуются в клетках и способны ускорять биохимические процессы, т.е. это биологические катализаторы.
Многие ферменты для проявления каталитической активности нуждаются в присутствии некоторых веществ небелковой природы - кофакторов. Различают 2 группы кофакторов - ионы металлов (а также некоторые неорганические соединения) и коферменты, которые представляют собой органические вещества. В числе коферментов есть такие, которые содержат металлы (железо в геме, кобальт в кобаламиде).
Сходства ферментов и неорганических катализаторов:
- 1. катализируют только энергетически возможные реакции;
- 2. не изменяют равновесия в обратимых реакциях;
- 3. не изменяют направление реакции;
- 4. не расходуются в результате реакции.
Отличия между ферментами и неорганическими катализаторами (общие свойства ферментов):
- 1. сложность строения;
- 2. высокая мощность действия. За единицу фермента принимают такое его количество, которое катализирует превращение 1мкМ вещества за 1 минуту;
- 3. специфичность;
- 4. это вещества с регулируемой активностью;
действуют в мягких условиях организма.
Давно выяснено, что все ферменты являются белками и обладают всеми свойствами белков. Поэтому подобно белкам ферменты делятся на простые и сложные.
Простые ферменты состоят только из аминокислот - например, пепсин, трипсин, лизоцим.
Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот - апофермент, и небелковую часть - кофактор. Кофактор, в свою очередь, может называться коферментом или простетической группой. Примером могут быть сукцинатдегидрогеназа (содержит ФАД) (в цикле трикарбоновых кислот), аминотрансферазы (содержат пиридоксальфосфат) (функция), пероксидаза (содержит гем). Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут.
По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов (КФ, EC -- Enzyme Comission code). Классификация была предложена Международным союзом биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом:
- 1. Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа
- 2. Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ.
- 3. Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза
- 4. Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов.
- 5. Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата.
- 6. Лигазы, катализирующие образование химических связей между субстратами за счет гидролиза АТФ. Пример: ДНК-полимераза
Вопрос 18. Сходство и отличие ферментов и неорганических катализаторов. Зависимость скорости ферментативных реакций от температуры, рН. Виды специфичности.
Строение простых и сложных ферментов (на примере гидролаз, дегидрогеназ).
По составу ферменты делятся на простые и сложные.
Простые ферменты состоят из аминокислот. К ним относятся ферменты желудочно-кишечного тракта – α-амилаза, пепсин, трипсин, липаза и др. Все эти ферменты относятся к 3 классу – гидролаз.
Сложные ферменты состоят из белковой части – апофермента и небелковой – кофактора. Каталитически активный комплекс «фермент – кофактор» называется холоферментом. В качестве кофакторов могут выступать как ионы металлов, так и органические соединения, многие из которых являются производными витаминов.
Например, оксидоредуктазы используют в качестве кофакторов Fe²+, Сu²+, Mn²+, киназы Mg²+; для глутатионпероксидазы – фермента, обезвреживающего перекись водорода, требуется селен.
Коферменты – это органические вещества, которые непрочно связаны с белковой частью. Например, НАД-зависимые дегидрогеназы состоят из белка и коферментов НАД, НАДФ, производных витамина РР.
Простетическая группа – это коферменты, которые прочно (часто ковалентно) связаны с апоферментом. Например, флавиновые дегидрогеназы состоят из белка и простетических групп ФАД, ФМН, производных витамина В 2 . Апофермент определяет направленность или специфичность действия фермента.
. Общие свойства ферментов: специфичность, влияние температуры, pH среды на активность ферментов.
На активность ферментов оказывают влияние температура, рН среды, ионная сила растворов.
Так как ферменты по химической природе являются белками, повышение температуры свыше 45-50˚С приводит к тепловой денатурации и ферменты инактивируются (исключение – миокиназа мышц, папаин).
Низкие температуры не разрушают ферменты, а только приостанавливают их действие. Оптимальная температура для проявления активности фермента равна 37-40˚С.
На активность ферментов оказывает влияние реакция среды. Значение рН среды, при котором фермент проявляет максимальную активность, называют оптимумом рН среды для действия данного фермента. РН-оптимум действия ферментов лежит в пределах физиологических значений 6,0-8,0. Исключения: пепсин, рН-оптимум которого равен 2,0; аргиназа – рН-оптимум равен 10,0.
Ферменты обладают специфичностью. Различают несколько видов специфичности:
1. Абсолютная специфичность – фермент взаимодействует только с одним субстратом. Например, уреаза ускоряет гидролиз мочевины, но не расщепляет тиомочевину.
2. Стереоспецифичность – фермент взаимодействует с определенным оптическим и геометрическим изомером.
3. Абсолютная групповая специфичность – ферменты специфичны в отношении характера связи, а также тех соединений, которые образуют эту связь. Например, α-амилаза расщепляет α-гликозидную связь в молекуле мальтозы, состоящей из двух молекул глюкозы, но не расщепляет молекулу сахарозы, состоящую из молекулы глюкозы и молекулы фруктозы.
4. Относительная групповая специфичность. В этом случае ферменты специфичны только в отношении связи, но безразличны к тем соединениям, которые образуют эту связь. Например, протеазы ускоряют гидролиз пептидных связей в различных белках, липазы ускоряют расщепление сложноэфирных связей в жирах.
Вопрос 19 Активаторы и ингибиторы ферментов. Механизм их действия. Обратимое и необратимое, конкурентное и неконкурентное ингибирование. Использование принципа конкурентного ингибирования в медицине.
.Активаторы и ингибиторы ферментов, механизмы их влияния и значение.
На скорость химических реакций оказывают влияние различные вещества. По характеру влияния вещества подразделяются на активаторы, увеличивающие активность ферментов, и ингибиторы (парализаторы), подавляющие активность ферментов.
Активирование ферментов могут вызывать:
1. Присутствие кофакторов – ионы металлов Fe²+, Mg²+, Mn²+, Cu²+, Zn²+, АТФ, липоевая кислота.
2. Частичный их протеолиз.
Ферменты желудочно-кишечного тракта вырабатываются в виде неактивных форм – зимогенов. Под влиянием различных факторов происходит отщепление пептида с формированием активного центра и зимоген превращается в активную форму фермента.
Пепсиноген НСl пепсин + пептид
Трипсиноген энтерокиназа трипсин + пептид
Этот вид активирования предохраняет клетки желудочно-кишечного тракта от самопереваривания.
3. Фосфорилирование и дефосфорилирование. Например:
неакт. липаза + АТФ → липаза-фосфат (акт. липаза);
липаза-фосфат+Н3РО4 → липаза (неакт. липаза)
Ингибиторы по характеру своего действия подразделяются на обратимые и необратимые. В основе такого деления лежит прочность соединения ингибитора с ферментом.
Обратимые ингибиторы – это соединения, которые нековалентно взаимодействуют с ферментом и могут отщепляться от фермента.
Необратимые ингибиторы – это соединения, которые образуют ковалентные, прочные связи с ферментом.
Необратимое ингибирование может быть специфическим и неспецифическим.
При специфическом ингибировании ингибиторы тормозят действие определенных ферментов, связывая отдельные функциональные группы активного центра. Например, тиоловые яды ингибируют ферменты, в активный центр которых входят SН-группы; угарный газ (СО) ингибирует ферменты, имеющие в активном центре Fe²+.
Неспецифические ингибиторы тормозят действие всех ферментов. К ним относятся все денатурирующие факторы (высокая температура, органические и минеральные кислоты, соли тяжелых металлов и др.).
Обратимое ингибирование может быть конкурентным. При этом ингибитор является структурным аналогом субстрата и конкурирует с ним за связывание в субстратсвязывающем участке активного центра.
Отличительная особенность конкурентного ингибирования состоит в том, что его можно ослабить или полностью устранить, повысив концентрацию субстрата.
Сукцинатдегидрогеназа (СДГ) – фермент цитратного цикла, дегидрирует сукцинат, превращая его в фумарат. Малонат, который структурно похож на сукцинат, связывается в активном центре СДГ, но не может дегидрироваться. Поэтому малонат – конкурентный ингибитор СДГ.
Многие лекарственные препараты являются конкурентными ингибиторами ферментов. Например, сульфаниламидные препараты, являясь структурными аналогами парааминобензойной кислоты (ПАБК) – основного фактора роста болезнетворных микроорганизмов, конкурируют с ней за связывание в субстратсвязывающем участке активного центра фермента. На этом основано противомикробное действие сульфаниламидных препаратов.
Отличия:
1. Скорость ферментативных реакций выше, чем реакций, катализируемых неорганическими катализаторами.
2. Ферменты обладают высокой специфичностью к субстрату.
3. Ферменты по своей химической природе белки, катализаторы - неорганика.
4. Ферменты подвержены регуляции (есть активаторы и ингибиторы ферментов), неорганические катализаторы работают нерегулируемо.
5. Ферменты обладают конформационной лабильностью - способностью к небольшим изменениям своей структуры за счет разрыва и образования новых слабых связей.
6. Ферментативные реакции протекают только в физиологических условиях, т. к. работают внутри клеток, тканей и организма (это определенные значения температуры, давления и рН).
Общие свойства ферментов:
1. Не расходуются в процессе катализа ;
2. Имеют высокую активность по сравнению с катализаторами др. природы;
3. Обладают высокой специфичностью;
4. Лабильность (неустойчивость);
5. Ускоряют только те реакции, которые не противоречат законам термодинамики .
Общие свойства неорганических катализаторов:
1. Химическая природа - низкомолекулярные вещества;
2. В ходе реакции структура катализатора изменяется незначительно, или не изменяется вовсе;
3. Оптимум pH - сильнокислая или щелочная;
4. Увеличение скорости реакции намного меньше, чем при действии ферментов.
Специфичность - очень высокая избирательность ферментов по отношению к субстрату. Специфичность фермента объясняется совпадением пространственной конфигурации субстрата и субстратного центра. За специфичность фермента ответственен как активный центр фермента, так и вся его белковая молекула. Активный центр фермента определяет тип реакции, который может осуществить данный фермент. Различают три вида специфичности: абсолютную, относительную, стереохимическую.
Абсолютная специфичность. Такой специфичностью обладают ферменты, которые действуют только на один субстрат. Например, сахараза гидролизует только сахарозу , лактаза - лактозу, мальтаза - мальтозу, уреаза - мочевину, аргиназа - аргинин и т.д.
Относительная специфичность - это способность фермента действовать на группу субстратов с общим типом связи, т.е. относительная специфичность проявляется только по отношению к определенному типу связи в группе субстратов. Пример: липаза расщепляют сложноэфирную связь в жирах животного и растительного происхождения. Амилаза гидролизует α-гликозидную связь в крахмале, декстринах и гликогене. Алкогольдегидрогеназа окисляет спирты (метанол , этанол и др.).
Стереохимическая специфичность - это способность фермента действовать только на один стереоизомер. Например: 1) L, B-изомерия: L- амилаза слюны и сока поджелудочной железы расщепляет только L-глюкозидные связи в крахмале и не расщепляет D-глюкозидные связи клетчатки; 2) L и В-изомерия: В нашем организме превращения подвергаются только L-аминокислоты, т.к. эти превращения осуществляются ферментами L-оксидазами, способными реагировать только с L-формой аминокислот; 3) Цис-, транс-изомерия: Фумаратгидратаза может превращать только транс-изомер (фумаровую кислоту) в яблочную. Цис-изомер (малеиновая кислота) таким превращениям в нашем организме не подвергается.
Локализация ферментов зависит от их функций. Одни ферменты просто растворены в цитоплазме, другие связаны с определенными органоидами. Например, окислительно-восстановительные ферменты сосредоточены в митохондриях.
Эктоферменты - ферменты, локализующиеся в плазматической мембране и действующие снаружи от нее
Эндоферменты - функционируют внутри клетки. Они катализируют реакции биосинтеза и энергетического обмена.
Экзоферменты - выделяются клеткой в окружающую среду, за пределами клетки расщепляют крупные молекулы на более мелкие осколки и тем самым способствуют проникновению их в клетку. К ним относятся гидролитические ферменты, играющие исключительно важную роль в питании микроорганизмов.
Основу всех жизненных процессов составляют тысячи химических реакций, катализируемых ферментами. Значение ферментов точно и образно определил И.П.Павлов, назвав их "возбудителями жизни" . Нарушения в работе ферментов ведут к возникновению тяжелых заболеваний – фенилкетонурия , гликогенозы , галактоземия , тирозинемия или существенному снижению качества жизни – дислипопротеинемии , гемофилия.
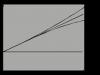
Известно, что для осуществления химической реакции необходимо, чтобы реагирующие вещества имели суммарную энергию выше, чем величина, называемая энергетическим барьером реакции. Для характеристики величины энергетического барьера Аррениус ввел понятие энергии активации . Преодоление энергии активации в химической реакции достигается либо увеличением энергии взаимодействующих молекул, например нагреванием, облучением, повышением давления, либо снижением требуемых для реакции затрат энергии (т.е. энергии активации) при помощи катализаторов.
Величина энергии активации с ферментом и без него
По своей функции ферменты являются биологическими катализаторами. Сущность действия ферментов, так же как неорганических катализаторов, заключается:
- в активации молекул реагирующих веществ,
- в разбиении реакции на несколько стадий, энергетический барьер каждой из которых ниже такового общей реакции.
Однако энергетически невозможные реакции ферменты катализировать не будут, они ускоряют только те реакции, которые могут идти в данных условиях.
Сходство и отличия ферментов и неорганических катализаторов
Ускорение реакций при помощи ферментов весьма значительно, например:
А. Уреаза ускоряет реакцию разложения вполне устойчивой мочевины до аммиака и воды в 10 13 раз, поэтому при инфекции мочевых путей (появление бактериальной уреазы) моча приобретает аммиачный запах.
Б. Рассмотрим реакцию разложения пероксида водорода:
2Н 2 О 2 → О 2 + 2Н 2 О
Если скорость реакции без катализатора принять за единицу, то в присутствии платиновой черни скорость реакции увеличивается в 2×10 4 раза и энергия активации снижается с 18 до 12 ккал/моль, в присутствии фермента каталазы скорость реакции возрастает в 2×10 11 раза с энергией активации 2 ккал/моль.